Psychotrianiauensis Butaud & J.Florence, 2020
|
publication ID |
https://doi.org/10.5252/adansonia2020v42a6 |
|
DOI |
https://doi.org/10.5281/zenodo.3809609 |
|
persistent identifier |
https://treatment.plazi.org/id/03D63B06-A016-FFDC-C9F0-F8C4FBFDFBD1 |
|
treatment provided by |
Carolina |
|
scientific name |
Psychotrianiauensis Butaud & J.Florence |
| status |
sp. nov. |
Psychotrianiauensis Butaud & J.Florence View in CoL , sp. nov.
( Figs 3 View FIG ; 4 View FIG )
P. leiophyllae Merr. & L.M.Perry affinis, sedsemper munitispedunculo longiori quam 3,5 cm inflorescentiis (vs sessilia atquee base ramosa vel pedunculominusquam 3 cm inflorescentia), ovoideisminus quam 3 mm crassis pyrenis (vs subellipsoideas vel subglobosas ultra 3,5 mm crassas pyrenas), minus quam 1 cm longo petiolo (vs 1-5 cm), praecipue differt.
TYPUS. — Polynésie française, Archipeldes Tuamotu. Atollde Niau, Ouest de l’aéroport, coté lagon en arrière des zones d’extraction, 8 m, 16°09’S, 146°24’W, 17.X.2006, fl. & fr., J.- F. Butaud 1519 (holo-, P!; iso-, PAP [ PAP015889 !]) ( Fig. 5 View FIG ). GoogleMaps
PARATYPI. — Polynésie française, Archipeldes Tuamotu. Atoll de Niau, Tupana, derrière le cimetière, 8 m, 16°08’S, 146°20’W, 13.X.2006, fr., J.- F. Butaud 1498 ( PAP [ PAP015764 !]) GoogleMaps ; Tupana, derrière le cimetière, 8 m, 16°08’S, 146°20’W, 13.X.2006, fl., J.- F. Butaud 1499 ( PAP [ PAP015763 !]) GoogleMaps ; Tupana, enarrièreducimetière, 8 m, 16°08’S, 146°20’W, 24.X.2006, fl., fr., J.- F. Butaud 1540 ( PAP [ PAP015890 , PAP015891 ]! GoogleMaps ; P!) .
PHÉNOLOGIE. — En fleurs et enfruits en février, mars, juin, octobre et novembre, d’après les échantillons d’herbier et les observations de différents botanistes.
ÉTYMOLOGIE. — Le nom d’espèce se réfère à l’atoll de Niau duquel la plante est endémique.
NOM LOCAL ET USAGES. — Aucun nom polynésien ni aucun usage n’ont été relevés pour cette espèce à Niau.
DESCRIPTION
Arbuste atteignant 1,5 à 2 m de hauteur et 5 cm de diamètre à la base, entièrement glabre, au port parfois retombant, aux rameaux longtemps chlorophylliens de 2 à 3 mm de diamètre, souvent aplatis, puis à écorce brunâtre et lisse. Rameaux, face inférieure desfeuilles et ramilles de l’inflorescenceparsemés de faisceaux de raphides, de 0,2-0,7 mm de longueur.
Feuilles
Opposées-décussées, limbede 7,5-15 × 2,5-5,5 cm (1,8 <L/l <3,2), elliptique à obovale, charnu, souple, brillant sur la face supérieure àl’état frais, base cunéiforme longuement décurrente sur le pétiole, apex aigu à obtus, (4)5 à 7 paires de nervures secondaires, eucamptodromesà faiblementbrochidodromes; pétiolede 4-10 mm; stipules interpétiolaires, sefragmentant rapidement par l’apex, largement triangulaires à engainantes, 1,5 × 2 mm, parfois bifidessur moins de 0,5 mm en se fendant longitudinalement, face interne à nombreux colleters bruns.
Inflorescences
Terminales, cymeuses, non calyptrées, de (5-)6,7-15,5 × (2,2-) 4,5-10 cm, avec 50 à 65 fleurs, pédoncule unique de 3,5-10 cm, se divisant en 4 à 5 cymesdichasiales ou verticillées, parfoiscontractées jusqu’à devenir subcapitées, ramifiées 3 à 4 fois, les ramifications ultimes portant 3 (ou 4) fleurs; paires de bractées séteuses, 0,8 × 0,3 mm, au sommet du pédoncule et des divisons successives.
Fleurs
Hermaphrodites, pédicellede 1-1,5 mm. Hypantheobconique de 1-1,2 mm de longueur. Calice verdâtre, tube de 0,8-1 mm de longueur, (4) 5 (6) lobes dressés largement triangulaires de 0,5 mm de longueur. Corolle blanche, de 3 mm de hauteur et 7 mm de diamètre, hypocratériforme, tube barbu sur la face interne, 2-2,5 mm de longueur et (4) 5 (6) lobes étroitement ovales, 2,5-3 × 1,5-2 mm, révolutés; étaminesblanchesàjaunâtres, exsertes, (4) 5 (6) anthères longues de 1,3 mm. Style long de 3,5 mm et stigmate divisé en deux lobes papilleux ovoïdes; hétérostylie non observée.
Fruit
Drupacé, tronconique à l’état immature à cylindrique à maturité, de 7 × 6-7 mm, rose à violet noirâtre à maturité, couronné par les dents du calice verdâtres, comportant deuxpyrènes; pédicellede 2 mm; pyrènes ovoïdes, hémisphériques en coupe, 4,5-5 × 2,5-3 × 2 mm, à face ventrale plane, traversée longitudinalement par un sillon bisulqué central, largede 0,5 mm, etàface dorsalearrondieetlisse; absence de fente de germination préformée, mais présence d’unporeapical.
Psychotrialeiophylla Merr. & L.M.Perry &
Caractère Eumachia DC. P. niauensis Butaud & J.Florence sp. nov.
Type biologique Arbuste ou petit arbre Arbuste
Raphides Présence Présence
Couleur des parties végétatives Vert jaunâtre pâle à l’état sec Vert jaunâtre pâle à l’état sec
Texture des rameaux Lisses et non liégeux Lisses et non liégeux
Forme des jeunes rameaux et entrenoeuds Souvent aplatis Souvent aplatis
Position et forme des stipules Interpétiolaires, entières, généralement unies Interpétiolaires, parfois bifides, non calyptrées à la base ou calyptrées sur une grande
partie de leur longueur
Persistance des stipules Semi-décidues, devenant indurées et Semi-décidues, leurs extrémités se
leurs extrémités se désagrégeant désagrégeant progressivement progressivement
Inflorescences Cymeuses aux ramilles vertes à blanchies Cymes composées aux ramilles vertes
Forme du calice et de la corolle Actinomorphe, corolle infundibuliforme à Actinomorphe, corolle hypocratériforme hypocratériforme
Couleur de la corolle Blanc, crème, vert-jaune Blanc
Préfloraison Valvaire Valvaire
Pilosité de la gorge de la corolle Barbue Barbue
Style Hétérostyle Homostyle
Polymérie 4 ou 5-mère 5-mère
Ovaire Biloculaire aux ovules solitaires et basaux Biloculaire aux ovules solitaires et basaux dans chaque loge dans chaque loge
Type et forme de fruit Drupacé, ellipsoïde à subglobuleux Drupacé, tronconique
Couleur du fruit Orange à rouge Rose, pourpre à violet
Forme des pyrènes Hémisphérique en coupe Hémisphérique en coupe
Face dorsale du pyrène Lisse à côtelée Lisse
Face ventrale du pyrène Planeàconcaveetsanssillonlongitudinal Planeavecsillonlongitudinalbisulqué
Fente de germination préformée Présencede 2 fentesenpositionmarginale Aucunefentemaisprésenced’unporeapical sur la base de la face ventrale
Albumen Non ruminé, souvent avec une petite Non ruminé, sans invagination au centre de la invagination au centre de la face ventrale face ventrale
Présence dans le tégument d’un pigment Non Oui
rouge soluble à l’éthanol
Graine
Àalbumen non ruminé, doté d’un pigment tégumentaire rouge soluble à l’éthanol.
AFFINITÉS
Les affinités de P. niauensis sp. nov. sont clairement à rechercher avec P. leiophylla des Îles Salomon et de la Polynésie occidentale (Fidji, Samoa et Tonga), puisque seuls des caractères relativement mineurs, mais notables et récurrents permettent de l’en distinguer (voir la diagnose) et d’autres l’en rapprochent (dont les fruits de couleur rose, violet ou pourpre, le pore apical du pyrène lisse, le pigment tégumentaire soluble à l’éthanol). Plus précisément, P. niauensis sp. nov. se distingue de Psychotria leiophylla par ses inflorescences toujours pédonculées avec un pédoncule de plus de 3,5 cm, tandis qu’elles sont ramifiées dès la base ou pédonculées sur moins de 3 cm chez P. leiophylla . Les pyrènes de cette dernière sont subellipsoïdaux à subglobuleux et mesurent plus de 3,5 mm de largeur, tandis que ceux de P. niauensis sp. nov. sont ovoïdes et mesurent moins de 3 mm de largeur. Enfin, le pétiole de P. leiophylla atteint 1-5 cm, tandis que celui de P. niauensis sp. nov. est inférieur à 1 cm.
Ces deux espèces appartiennent très probablement au sous-clade PNG du clade IV de Barrabé (2013) et Barrabé et al. (2014) présent en Nouvelle-Guinée, Micronésie, Mélanésie et Polynésie occidentale, jusqu’alors absent de la Polynésie orientale. Psychotrianiauensis sp. nov. résulte ainsi d’un événement de dispersion distinct de ceux de tous les autres Psychotria de la région, qui appartiennent apparemment uniquement au clade Pacifique. Le seul Eumachia de Polynésie orientale, E. lepiniana endémique de l’île de Tahiti, ainsi qu’un taxon proche non décrit propre à l’île de Raiatea, font partie, quant à eux, du sous-clade carnea de Barrabé et al. (2012).
Les affinités avec P. leiophylla sont également écologiques, puisque ces deux espèces se cantonnent le plus souvent aux stations littorales, souvent sur calcaire soulevé, aux Salomon, Fidji, Tonga et Tuamotu avec, néanmoins, des stations de P. leiophylla plus à l’intérieur des terres aux Samoa, entre 400 et 850 md’altitude ( Smith & Darwin 1988; Whistler 2011). Whistler (2011) met en doute la présence de cette dernière aux Samoa, notamment en raison de la couleur rouge des fruits mûrs de ce taxon, rappelant donc plutôt ceux d’ Eumachia forsteriana , tandis que ceux de Tonga sont pourpres. Des études semblent encore nécessaires afin de clarifier la situation aux Samoa, mais l’examen des images de certains spécimens d’herbier (notamment Whistler 899 [BISH417668] collectéà Savai’i) nousfait penchersurune présence effective de P. leiophylla aux Samoa.
RÉPARTITION, HABITAT & ÉCOLOGIE
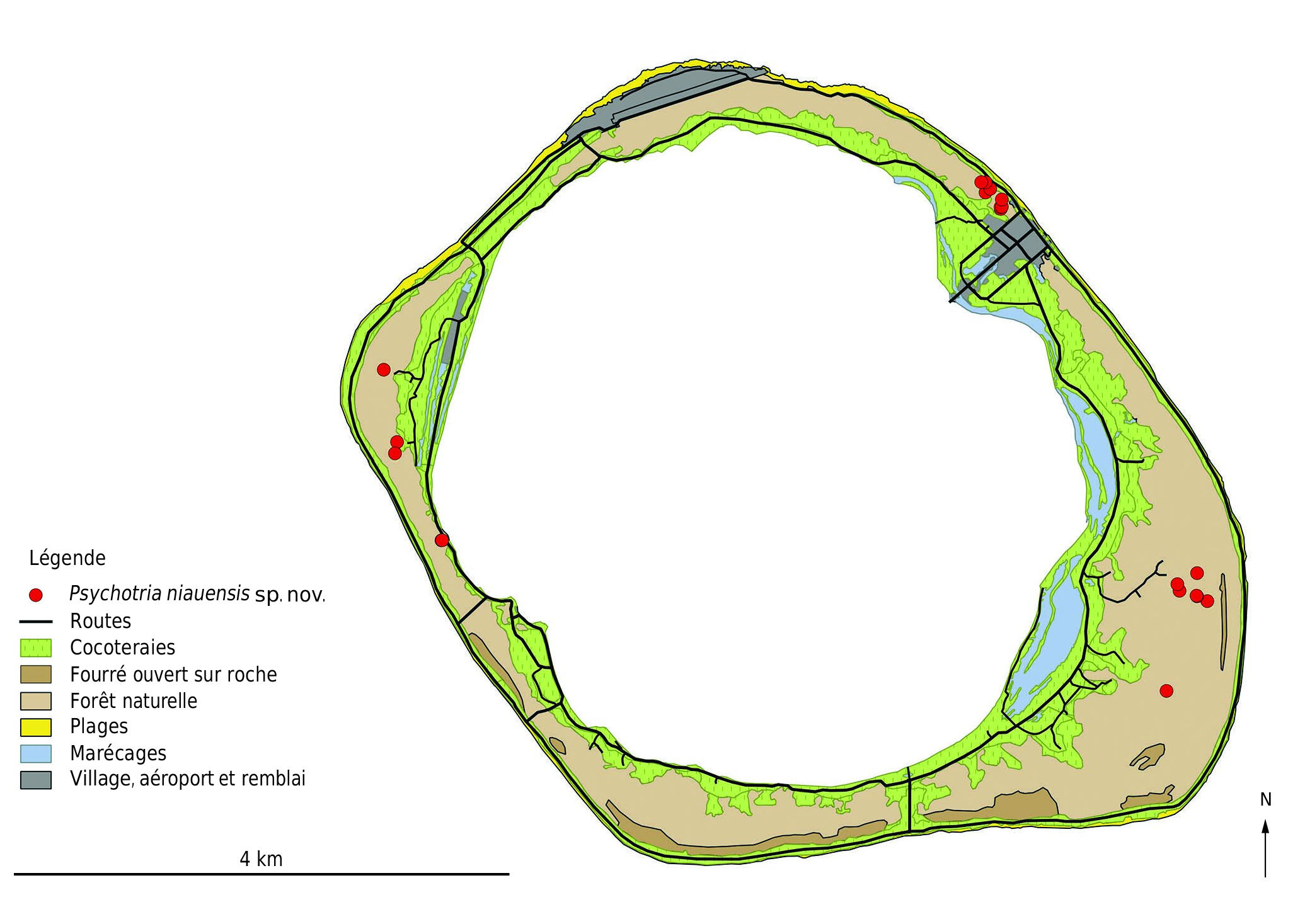
Psychotria niauensis sp. nov. n’est connue en Polynésie française que de l’atoll soulevé de Niau ( 6 m d’altitude maximale) et constitue le seul représentant de son genre dans tout l’archipel des Tuamotu.
Sur l’atoll de Niau, Psychotria niauensis sp. nov. a été identifiée après des prospections intensives dans des sites qu’ilestpossiblederegrouperentroissous-populations: à l’ouest du village de Tupana dans le nord-est, à Vaiava dans l’est et à Tapae à l’ouest ( Fig. 6 View FIG ). Un total de 78 pieds a été décompté lors de ces prospections, dont la moitié dans la localité de Tupana.
Il s’agit d’un arbuste de sous-bois des forêts peu perturbées sur corail soulevé dominées par les arbres indigènes Glochidion tuamotuense J.Florence (Phyllanthaceae) , Guettarda speciosa L. ( Rubiaceae ), Pandanus tectorius Parkinson ex Du Roi (Pandanaceae) , Pisonia grandis R.Br. (Nyctaginaceae) , Planchonella tahitensis (Nadeaud) Pierre ex Dubard (Sapotaceae) , Xylosma suaveolens (J.R.Forst. & G.Forst.) G.Forst. (Salicaceae) , les arbustes indigènes Allophylus rhomboidalis (Nadeaud) Radlk. (Sapindaceae) , Cyclophyllum barbatum (G.Forst.) N.Hallé & J.Florence (Rubiaceae) , Ixora sp. ( Rubiaceae ), « Meryta sp. nov.» ( Araliaceae ), Morinda citrifolia L. ( Rubiaceae ), Myrsine niauensis Fosberg & Sachet (Primulaceae) , Tarenna sambucina (G.Forst.) T.Durand ex Drake (Rubiaceae) , Premna serratifolia L. ( Lamiaceae ), l’herbacée indigène Peperomia pallida (G.Forst.) A.Diet. (Piperaceae) , les lianes indigènes Capparis spinosa subsp. cordifolia (Lam.) Fici (Capparidaceae) , Gynochthodes myrtifolia (A.Gray) Razafim. & B.Bremer (Rubiaceae) , lesfougères indigènes Asplenium nidus L. & Asplenium polyodon G.Forst. (Aspleniaceae) , Microsorum grossum (Langsd. & Fisch.) S.B.Andrews (Polypodiaceae) et le palmier introduit Cocos nucifera L. ( Arecaceae ).
Avec ses fruits charnus violets à pourpres à maturité, cet arbuste est très probablement disséminé par des oiseauxfrugivores, au premier rang desquels figure le Ptilope des Tuamotu ( Ptilinopus coralensis Peale, 1848), endémique de l’archipel et abondant dans les forêts naturelles de l’île. La pollinisation est très probablement assurée par des insectes, mais aucune observation probante n’a été réalisée. Seule la fourmi d’introduction moderne Monomorium floricola (Jerdon, 1851) a été observée sur les fleurs de P. niauensis sp. nov. en train de prospecter pour du nectar, mais sa très petite taille exclut tout rôle de dissémination du pollen.
STATUT DE CONSERVATION
P. niauensis sp. nov. n’est connue que de l’atoll de Niau dont la superficie atteint 21,5 km ². Elle est présente sous la forme de 3 sous-populations distantes les unes des autres de moins de 5 km ( Fig. 6 View FIG ) et au sein desquelles près de 80 pieds ont étédénombrés; cenombre estprobablementsous-estiméen raison de sa discrétion à l’état stérile. Elle est essentiellement menacée par la dégradation de sonhabitat liéeà l’urbanisation (la sous-population principale située à proximité du village de Tupana étant incluse dans la zone urbaine – UB du Plan Général d’Aménagement [PGA] de la Commune de Fakarava dont fait partie l’atoll de Niau), aux incendies consécutifs à la culture du coprah et débordant sur les forêts naturelles et à l’extension de plantes envahissantes, en particulier l’arbre Syzygium cumini (L.) Skeels ( Myrtaceae ) déjà présent sous la forme de pieds-mères isolés et de plantules à proximité de ses stations, et faisant officiellement partie des espèces menaçant la biodiversité en Polynésie française (arrêté 466 CM du 22 mars 2018). La diversité des menaces pesant sur lesdifférentes sous-populationsconduit à retenir deux localités, la première de Tupana étant très menacée par l’urbanisation, car non prise en compte par le PGA, tandis que la seconde regroupant les deux autres sous-populations est intégrée à la zone de site protégé de la zone tampon – NDzt du PGA.
L’aire d’occupation de l’espèce, en se fondant sur des carrés d’un kilomètre de côté, atteint 6 km ², tandis que son aire d’occurrence est inférieure à 50 km ². Cette aire de répartition n’est pas considérée comme sévèrement fragmentée, en raison de la proximité des trois sous-populations ou des deux localitéset de la présence d’un oiseau frugivore disséminateur des semences. En raison des incendies récurrents, de l’agrandissement progressif du village de Tupana et du développement de l’envahissant Syzygium cumini, un déclin continu a été estimé pour l’étendue et la qualité de son habitat. Ainsi, en utilisant le critère Bde la liste rouge de l’UICN ( IUCN 2019), P.niauensis sp. nov. peut être évaluée comme en danger d’extinction EN B1, B2ab(iii).
En utilisant le critère Det avec 80 individus recensés (dont des juvéniles) et moins de 250 individus matures estimés, P. niauensis sp. nov. peut également être évaluée comme en danger d’extinction EN D.
| PAP |
PAP |
No known copyright restrictions apply. See Agosti, D., Egloff, W., 2009. Taxonomic information exchange and copyright: the Plazi approach. BMC Research Notes 2009, 2:53 for further explanation.
|
Kingdom |
|
|
Phylum |
|
|
Class |
|
|
Order |
|
|
Family |
|
|
Genus |