Meryta puruhi Butaud, J.Florence, Lowry & F.Tronchet
|
publication ID |
https://doi.org/ 10.5252/adansonia2023v45a4 |
|
DOI |
https://doi.org/10.5281/zenodo.7671018 |
|
persistent identifier |
https://treatment.plazi.org/id/03A9847D-FFCD-FF8F-FEF5-89949D13CF47 |
|
treatment provided by |
Felipe |
|
scientific name |
Meryta puruhi Butaud, J.Florence, Lowry & F.Tronchet |
| status |
sp. nov. |
Meryta puruhi Butaud, J.Florence, Lowry & F.Tronchet , sp. nov.
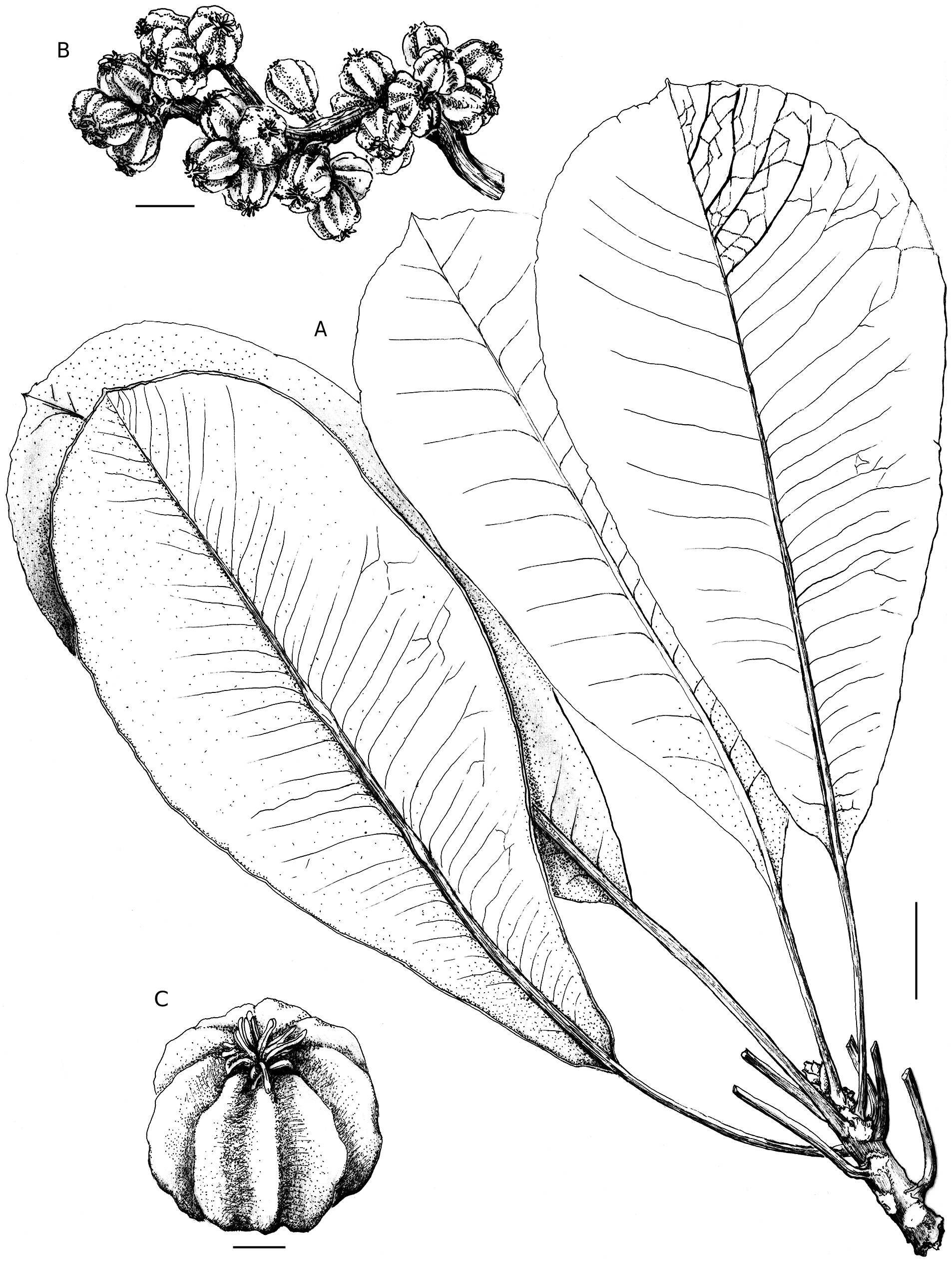
( Figs 2 View FIG ; 3 View FIG ; 4 View FIG )
Meryta puruhi inter Societatis insularum M. lanceolatae J.R.Forst. & G.Forst. et M. raiateensi J.W. Moore affinis , sed foliis obovatis vel spatulatis vs. lanceolatas vel oblongas illarum duarum specierum atque (7-)8-11 carpellis vs 4-6(-7), praecipue differt.
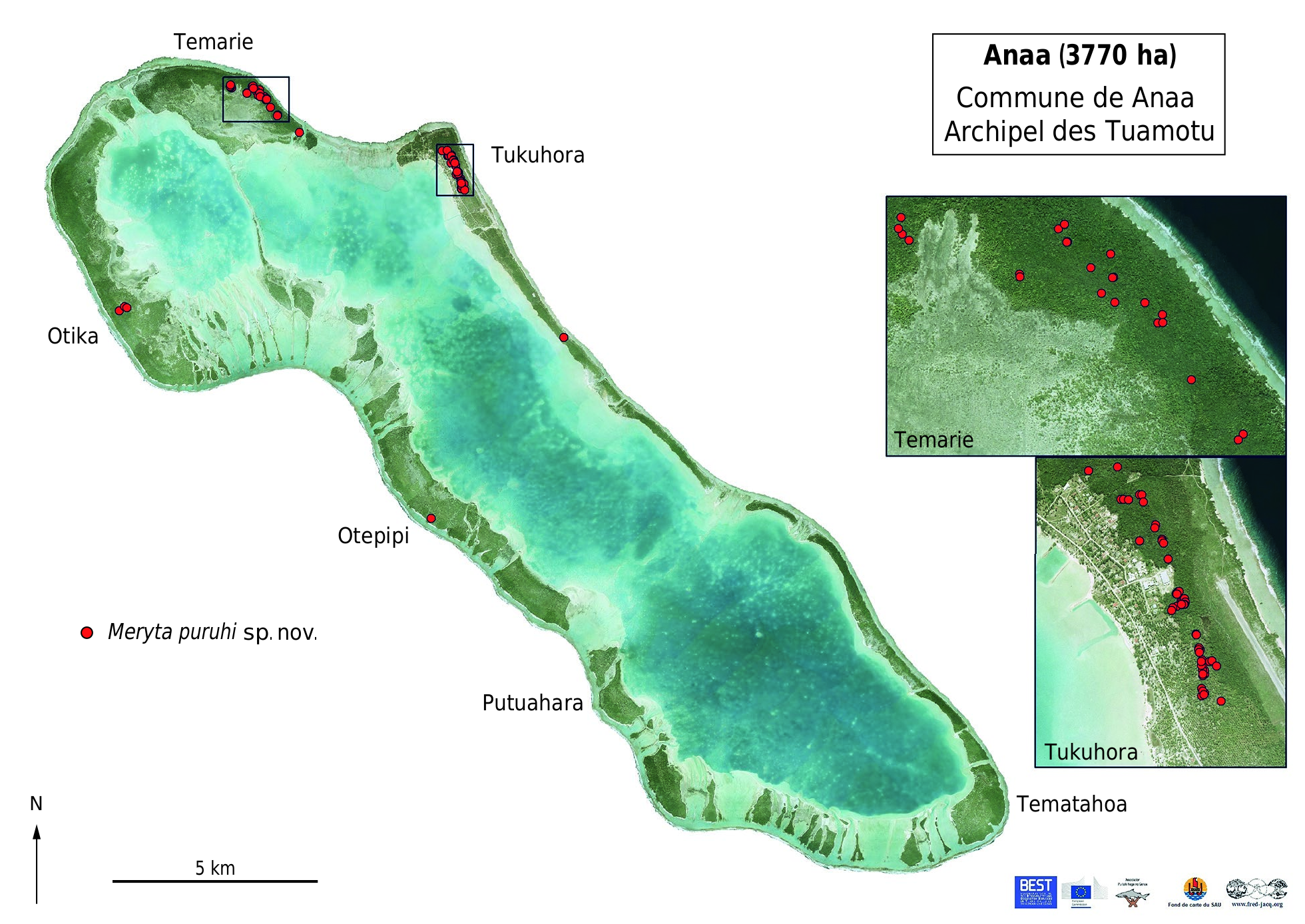
TYPUS. — Polynésie française, Archipel des Tuamotu. Atoll de Anaa, Tukuhora , au sud-est de la mare aux anguilles, mince bande de feo entre cocoteraie, Premna , Xylosma , Pandanus , Morinda myrtifolia et M. citrifolia, Laportea , Asplenium nidus , Capparis , 17°20’58.992”S, 145°30’51.012”W, 5 m, 17.VI.2005, fr., J.-F. Butaud 1142 (holo-, PAP[PAP010427!]; GoogleMaps iso-, P[P00398291, P00398359]!; GoogleMaps PAP[PAP010428!]) ( Fig. 4 View FIG ) GoogleMaps .
PARATYPI. — Polynésie française. Archipel des Tuamotu. Atoll de Niau, Tupana, derrière le cimetière, sous-bois de Guettarda , Pouteria , Myrsine , Glochidion , Xylosma , Allophylus , Ixora , 16°07’48.4”S, 146°20’07.3”W, 8 m, 13.X.2006, fr., J.-F. Butaud 1500 (PAP[PAP015762]!); GoogleMaps Tupana, à l’ouest du village, Pandanus , Pouteria , Premna , Myrsine , Xylosma , Guettarda , Timonius , Cyclophyllum , Ixora , 16°07’32.7”S, 146°20’29.3”W, 8 m, 14.X.2006, fr., J.-F. Butaud 1505 (PAP[PAP015761]!); GoogleMaps Maiahu , au bout d’une route pénétrant les feo, 16°09’48.1”S, 146°19’13.8”W, 8 m, 23.X.2006, fl. ♂, J.-F. Butaud 1534 (PAP [PAP015892]!); GoogleMaps Village de Ofare , secteur sud-ouest, forêt de makatea avec Pipturus , Myrsine , Guettarda , [16°8’S, 146°23’W], 2 m, 28.III.1990, stér., J. Florence 10139 (BISH, K, MO!, P[P00398362]!, PAP[PAP000550]!, US[US3294808]!); GoogleMaps Maiahu, secteur sud-ouest, Forêt de makatea avec Pisonia , Planchonella , [20°11’S, 146°21’W], 1 m, 31.III.1990, stér., J. Florence 10175 (BISH, K, MO!, P[P00398363]!, PAP[PAP000551]!, US); GoogleMaps Maiahu, secteur sud-ouest, forêt de makatea en sous-bois sur calcaire érodé, [20°11’S, 146°21’W], 1 m, 2.IV.1990, fr., J. Florence 10188 (P[P00398364]!, PAP[PAP000552]!). GoogleMaps — Atoll de Anaa. Tukuhora , au sud-est de la mare aux anguilles, feo, Asplenium nidus , Guettarda Microsorum , Timonius , Pipturus , Xylosma , Cocos, Laportea , 17°20’58.94’’S, 145°30’51.29’’W, 5 m, 17.VI.2005, fl. ♂, J.-F. Butaud 1141 (BISH!, P[P00398288, P00398358]!; GoogleMaps PAP[PAP010431, PAP010433]!; PTBG!); GoogleMaps Tukuhora, au sud-est de la mare aux anguilles, mince bande de feo entre cocoteraies, 17°20’58.94”S, 145°30’51.29”W, 5 m, 17.VI.2005, fl. ♂, J.-F. Butaud 1143 (P[P00398360]!; GoogleMaps PAP[PAP010426]!); GoogleMaps Tukuhora, est de Tevaiora, en bordure de zone marécageuse, Peperomia , Guettarda Psilotum , Pipturus , Pisonia , 17°20’58.9”S, 145°30’49.7”W, 5 m, 25.VIII.2008, fl. ♂, J.-F. Butaud & J. Kape 1910 (PAP[PAP015217]!); GoogleMaps ibid., 15.VII.2018, fr., J.-F. Butaud (leg. J. Hauata) 3703 (PAP[PAP015968]!); GoogleMaps ibid., 15.VII.2018, fl. ♂, J.-F. Butaud (leg. J. Hauata) 3704 (PAP[PAP015969]!); GoogleMaps ibid., 15.VII.2018, stér., J.-F. Butaud (leg. J. Hauata) 3705 (PAP[PAP015970]!); GoogleMaps Tukuhora, Moist woods on dissected coral rock, 13.V.1934, fr., H. St. John 14263 (BISH[BISH122845]!). GoogleMaps
ÉTYMOLOGIE. — L’épithète de cette espèce correspond au nom polynésien puruhi employé dans les deux îles pour la désigner.
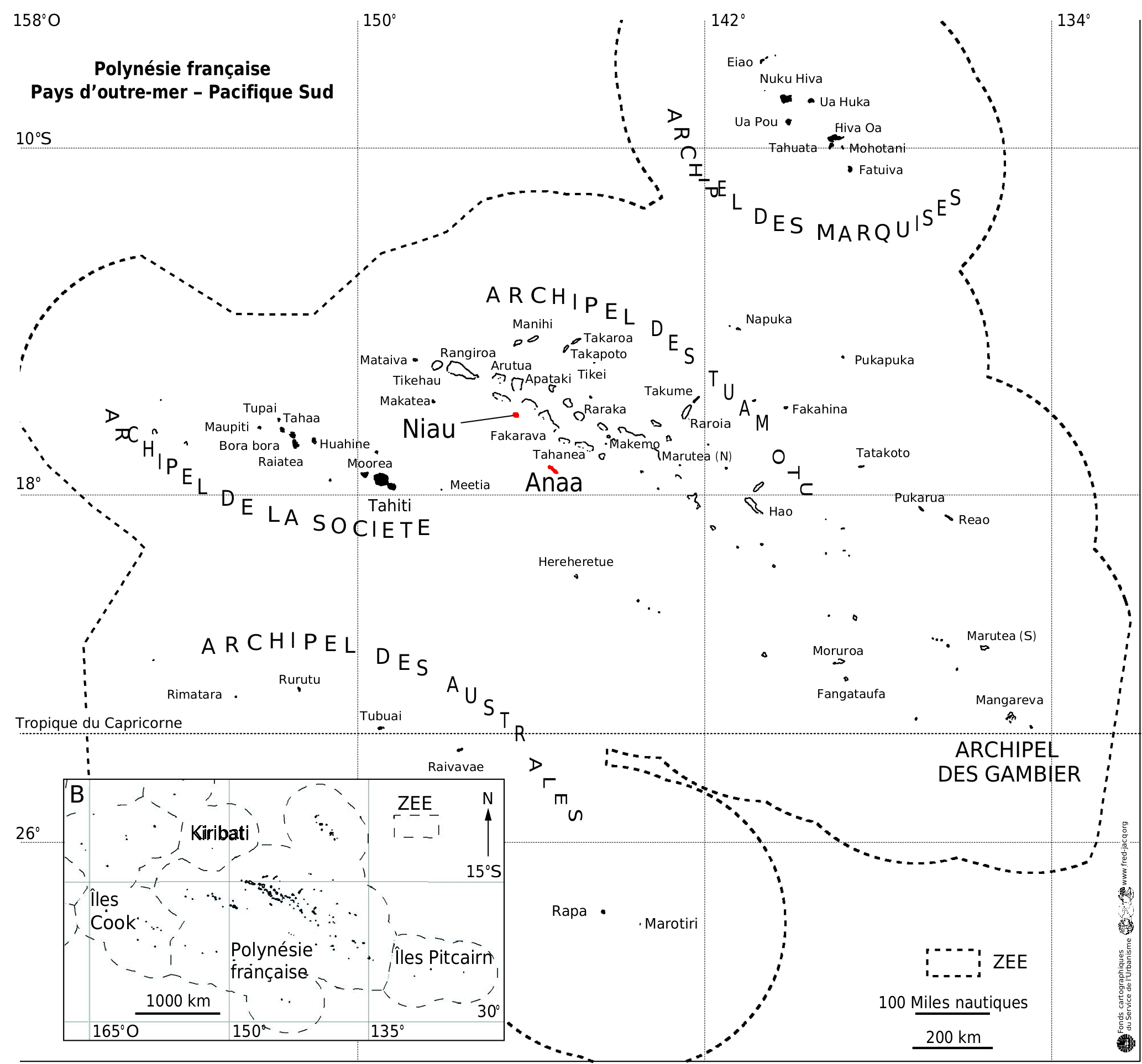
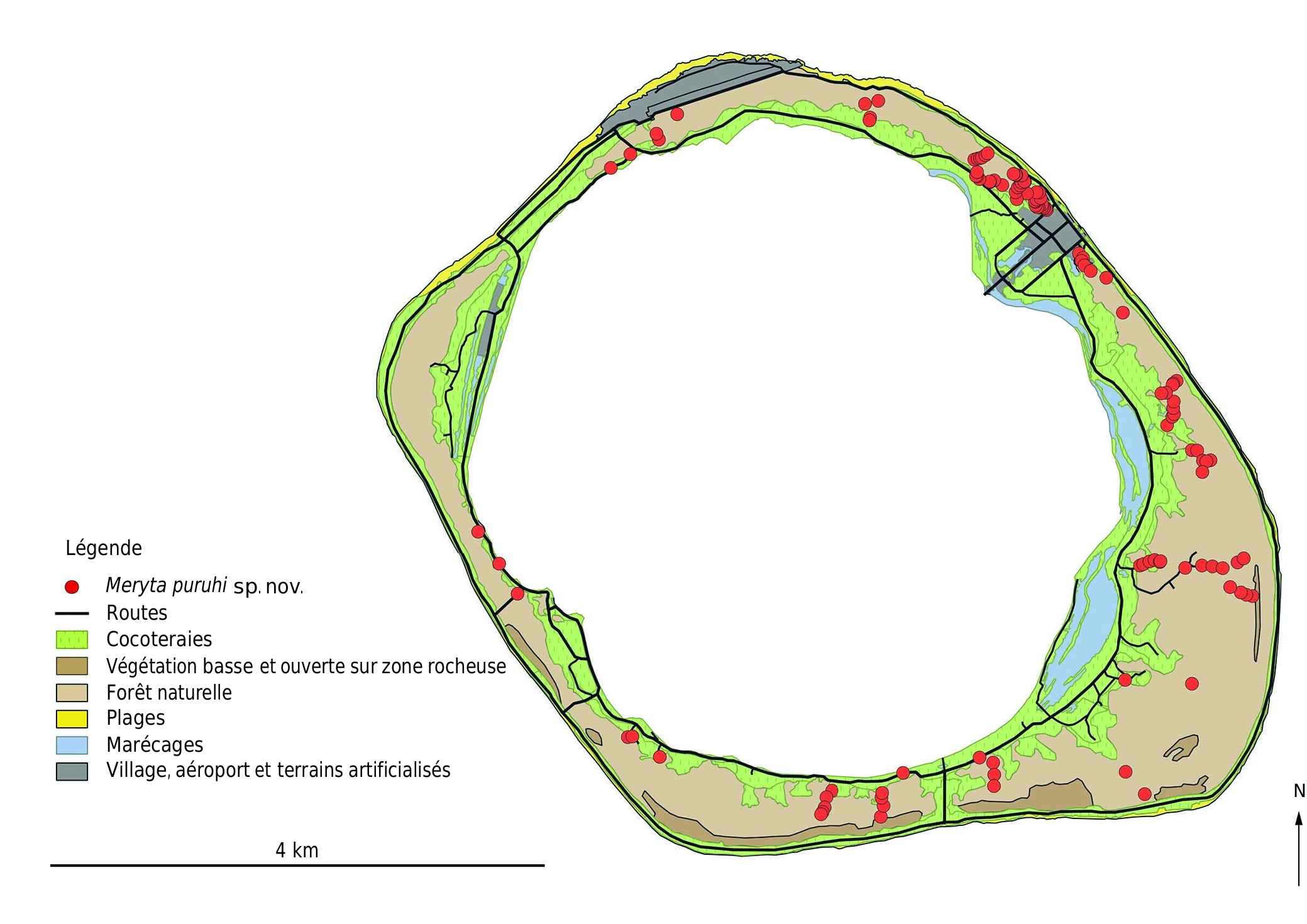
RÉPARTITION. — Meryta puruhi sp.nov. est restreinte aux parties surélevées des atolls de Niau (7,5 m d’altitude) et de Anaa (5 m), et constitue la seule espèce du genre dans l’archipel des Tuamotu en Polynésie française ( Fig. 1 View FIG ). À Niau, elle croît dans les forêts sur corail soulevé (feo) sur la quasi-totalité de l’atoll avec juste une absence dans la partie occidentale ( Fig. 5 View FIG ). À Anaa, elle n’est connue que des cinq principaux îlots de la moitié ouest de l’île ( Fig. 6 View FIG ), au sein du même type de forêt. La plupart des individus sont présents dans les sous-populations de Tukuhora et Temarie, tandis que celles de Ahuraka, Otepipi et Otika comprennent moins de dix individus chacune et apparaissent proches de l’extinction.
ÉCOLOGIE. — Ce petit arbre est cantonné aux zones de corail soulevé appelées heo ou feo dans les Tuamotu et en particulier dans les atolls de Niau et Anaa. C’est une espèce du sous-bois des forêts à Planchonella - Xylosma dominées par plusieurs arbres indigènes: Celtis pacifica Planch. (Cannabaceae) , Glochidion spp. (Phyllanthaceae) , Guettarda speciosa L. ( Rubiaceae ), Pandanus tectorius Parkinson (Pandanaceae) , Pisonia grandis R.Br. (Nyctaginaceae) , Planchonella tahitensis (Nadeaud) Pierre ex Dubard (Sapotaceae) , Pritchardia mitiaroana J.Dransf. & Y.Ehrh. et Xylosma suaveolens (J.R.Forst. & G.Forst.) G.Forst. (Salicaceae) , ainsi que des arbustes indigènes comme Allophylus rhomboidalis (Nadeaud) Radlk. (Sapindaceae) , Cyclophyllum barbatum (G.Forst.) N.Hallé & J.Florence (Rubiaceae) , Ixora sp. (Rubiaceae) , Morinda citrifolia L. ( Rubiaceae ), Myrsine niauensis Fosberg & Sachet (Primulaceae) , Premna serratifolia L. ( Lamiaceae ) et Tarenna sambucina (G. Forst.) T. Durand ex Drake (Rubiaceae) . On y trouve également l’herbacée indigène Peperomia pallida (G. Forst.) A.Diet. (Piperaceae) , les lianes indigènes Capparis spinosa subsp. cordifolia (Lam.) Fici (Capparidaceae) , Gynochthodes myrtifolia (A.Gray) Razafim. & B.Bremer (Rubiaceae) , les fougères indigènes Asplenium nidus L. & A. listeri C.Chr. (Aspleniaceae) , et Micorosorum grossum (Langsd. & Fisch.) S.B.Andrews (Polypodiaceae) et le cocotier introduit Cocos nucifera L. ( Arecaceae ). Les fruits orange à maturité de Meryta puruhi sp. nov. sont consommés par le ptilope des Tuamotu ( Ptilinopus coralensis Peale, 1848 ), oiseau endémique de l’archipel, toujours présent à Niau, mais éteint localement à Anaa, qui en disperse les graines (Butaud, obs. pers.). Deux espèces de rats introduits se nourrissent des fruits mûrs ou immatures, Rattus rattus (Linnaeus, 1758) et probablement R. exulans (Peale, 1848) , mais il n’est pas déterminé s’ils participent à sa dissémination.
NOMS VERNACULAIRES. — Les habitants de Niau et de Anaa nomment cette espèce puruhi ( Butaud 2007, 2008; Butaud & Jacq 2017). À Anaa, ce nom a été initialement relevé pour le genre Meryta par St. John et indiqué sur l’étiquette de son échantillon 14263 collecté en 1934. Seuls de rares habitants connaissent toujours ce nom aujourd’hui. À Niau, plusieurs noms ont été relevés pour Meryta puruhi sp. nov. par Florence en 1990: pua sur son échantillon 10139, torotea sur le 10175, et opuhi sur le 10188. Une enquête de terrain conduite en 2006 par Butaud (2007) auprès d’une dizaine de personnes âgées a démontré que le nom puruhi est employé pour désigner Meryta puruhi sp. nov., tandis que pua se réfère à Fagraea berteroana A.Gray ex Benth. (Gentianaceae) , une espèce absente de l’île, torotea correspond à Allophylus rhomboidalis , et opuhi est généralement lié à l’herbacée ornementale introduite Alpinia purpurata (Vieill.) K.Schum. (Zingiberaceae) . Il est intéressant de noter que dans les Îles de la Société, le nom puruhi désigne Ceodes taitensis (Heimerl) E.F.S.Rossetto & Caraballo (Nyctaginaceae) , tandis que les différentes espèces de Meryta sont appelées ‘ofepara ( Butaud 2017). Sur l’île de Rapa aux Australes, puru est le nom de Meryta choristantha Harms ( Meyer 2011) , tandis qu’à Hiva Oa aux Marquises, kohepuru est celui de Meryta pastoralis (Tutana Tetuanui, comm. pers. 2022).
STATUT DE CONSERVATION. — Meryta puruhi sp. nov. est restreint aux deux atolls surélevés, Niau (21,5 km ²) et Anaa (37,7 km ²), qui sont éloignés de 150 km l’un de l’autre.À Anaa,150 individus (incluant à la fois les individus matures et immatures) ont été dénombrés sur cinq îlots, ce qui représente cinq sous-populations, tandis que plus de 400 individus formant une seule sous-population ont été recensés à Niau. Ces comptages ne sont pas exhaustifs et le nombre total d’individus matures sur les deux îles est estimé entre 500 et 1000. La zone d’occurrence (EOO) de cette espèce est d’environ 1700 km ² tandis que sa zone d’occupation (AOO) est de 28 km ², 8 km ² sur Anaa, en se basant sur des carrés de 1 km de côté, et presque tout l’atoll sur Niau (près de 20 km ²). Son aire géographique est considérée comme étant sévèrement fragmentée sur Anaa à cause de l’extinction du ptilope (genre Ptilinopus ), qui jouait localement un rôle important dans sa dissémination, mais également entre les deux atolls, eu égard à la relative grande distance les séparant, soit 150 km. En effet, cette grande distance n’a pas permis la recolonisation de Anaa par le ptilope des Tuamotu à partir de Niau ou d’autres atolls proches en plus de 150 ans (période de l’acquisition des premières données naturalistes sur Anaa et indiquant l’absence de ptilope). Il faut noter que d’autres oiseaux frugivores (notamment des espèces appartenant aux genres Ducula et Pampusana ) étaient probablement présents anciennement sur ces atolls mais en ont depuis disparu ( Thibault & Cibois 2017). Meryta puruhi sp. nov. est menacé à un faible niveau par l’arbre envahissant Syzygium cumini (L.) Skeels, à un niveau modéré par l’extinction de son principal disséminateur dans une partie de son aire de répartition et à un haut niveau par des incendies d’origine humaine liés à l’entretien des cocoteraies et par l’urbanisation qui touche des habitats riches en Meryta à travers l’extension des villages. En effet, la population principale de Tukuhora à Anaa est progressivement détruite par les remblais nécessaires à la construction de bâtiments divers, ainsi que par l’extension de la zone aéroportuaire et des dépotoirs. Une partie de son habitat à Niau est incluse dans la zone urbaine (UB) définie par le plan général d’aménagement (PGA) de la commune, tandis que le reste est situé en zone de site protégé (NDzt). En prenant en compte les menaces plausibles les plus sérieuses que sont les incendies et l’urbanisation, M. puruhi sp. nov. possède quatre localités, deux sur Anaa (village de Tukuhora et autres sous-populations) et deux sur Niau (zone urbaine et zone de site protégé). Un déclin continu de la zone d’occurrence, de la zone d’occupation, de la superficie, étendue et qualité de l’habitat favorable, du nombre de sous-populations et du nombre d’individus matures est projeté. Meryta puruhi sp. nov. serait ainsi évalué comme Vulnérable sur le critère C de la liste rouge de l’UICN (2012) en raison de la petite taille de sa population et de son déclin [C2a(i)], et également sur le critère D en lien avec le faible nombre d’individus matures [D1]. Néanmoins, sur le critère B, il peut être évalué comme En danger [EN B1ab(i,ii,iii,iv,v) + 2ab(i,ii,iii,iv,v)].
DESCRIPTION
Arbre monocaule à faiblement ramifié en candélabre, dioïque, de 3-8 m de hauteur et de 6-15 cm de diamètre à la base; bois tendre, écorce grise rugueuse.
Feuilles
Simples, alternes, groupées à l’extrémité des rameaux, les juvéniles et les adultes comparables, à légère odeur de carotte; pétiole robuste, de (1,8-)2,9-5,9(-7,3) cm × (1,5-) 2-4 mm, sans lenticelles, avec des stries transversales vert foncé sur les deux faces à l’état frais, à base légèrement élargie et faiblement engainante; ligule présente dessus à la base du pétiole, caduque rapidement, à portion libre triangulaire, longue de 5-6 mm, marges entières et apex aigu; limbe vert terne dessus sur le frais, légèrement plus clair dessous, largement obovale à étroitement oblong ou spatulé, de (12,4-)16,1-24,6(-30) × (6-)7-11,8(-13,5) cm (rapport L/l 1,6-2,5), membraneux à cartacé, glabre sur les deux faces, à base atténuée, légèrement asymétrique avec un déport de 2-8 mm, à marge entière, parfois faiblement et irrégulièrement crénelée, ondulée distalement, obscurément révolutée, apex aigu, obtus, arrondi à faiblement rétus, doté d’un acumen court largement triangulaire; nervation eucamptodrome à parfois brochidodrome, vert clair à l’état frais; nervure médiane saillante sur les deux faces, rectiligne, face inférieure sans ou jusqu’à deux épaississements restreints à la moitié proximale; 18 à 33 paires de nervures secondaires, divergeant sous un angle de 60-85° (au niveau de la plus grande largeur du limbe), nervures distales moins divergentes, nervures interstitielles souvent présentes; nervures tertiaires évidentes, rectilignes à s’anastomosant sous divers angles, formant rarement des arcs convexes dans la zone intercostale; nervures d’ordre supérieur visibles sur le sec, formant un réseau délicat et dense; veinules formant des aréoles quadrangulaires à polygonales de 0,5-1,5 mm.
Inflorescence mâle
Terminale, dressée, verte à jaune in vivo, en racème d’épis, avec 2 degrés de ramification, axe primaire long de 9,5- 12 cm × 4-5 mm à la base, axillé par des cataphylles caduques, laissant des cicatrices visibles, partie libre triangulaire, de 6-9 × 5-6 mm, marge entière à serrulée, apex aigu; 6 à 11 axes secondaires, longs de 2-12 cm (plus courts distalement), chacun axillé par une bractée caduque, largement triangulaire, longue de 7-10 mm, sans lenticelles, à marge entière à faiblement denticulée, apex obtus à aigu, parfois apiculé; capitules au nombre de 7-11 par axe secondaire, sessiles, avec 7 à 15(-27) fleurs, les proximaux insérés à 3-10 mm de la base, chacun axillé par une bractée caduque largement triangulaire.
Fleurs mâles
Sessiles, nues ou axillées par une bractéole persistante, oblongue à largement ovale, longue de 2,5-3 mm, aiguë au sommet; quatre ou cinq pétales, étroitement obovales, de 2,3-2,7 mm de longueur, hyalins; étamines à filets de 1,8-2,5 mm de long, anthères de 0,9-1,6 mm.
Inflorescence femelle
Description à partir des infrutescences. Terminale, dressée, verte à vert pâle sur le frais, en court racème d’épis, avec deux degrés de ramification, axe primaire long de 7-15 cm × 4-6 mm à la base, axillé par des cataphylles caduques, à marge serrulée, apex aigu; 8 à 13 axes secondaires, longs de 2-6 cm (plus courts distalement), chacun axillé par une bractée caduque largement triangulaire longue de 6-9 mm, sans lenticelles, à marge faiblement denticulée, apex aigu, parfois apiculé; capitules au nombre de 1-6 par axe secondaire, avec 4 à 16 fleurs, les proximaux insérés à 4-12 mm de la base de l’axe secondaire.
Fleurs femelles
Description d’après des images de très jeunes fruits. Sessiles; bractéole partiellement couverte par la fleur et plus tard par le fruit; huit pétales, persistants sur les fruits, triangulaires, récurvés lorsque la fleur est réceptive, apex aigu; (7-)8(-11) carpelles et stigmates.
Infrutescence
Généralement dressée, mais parfois pendante en raison du poids des fruits.
Fruits
Verts à l’état jeune, orange à maturité, restes des pétales persistants, non coalescents, ovaires libres les uns par rapport aux autres, mais basalement et parfois latéralement accolés; drupes globuleuses à subglobuleuses-déprimées, de 7-9 × (7-) 9-12,5 mm, lisses et charnues à l’état frais, profondément côtelées à l’état sec, les côtes correspondant aux 7-11 pyrènes, styles persistants et récurvés, d’environ 1,5-2 mm.
Pyrènes
De couleur crème, semi-ellipsoïdaux à semi-ovoïdes, nettement aplatis, de 5,5-6 × 3-4 × 1-2 mm, avec une petite arête proche du hile sur chaque face.
NOTES
Meryta puruhi sp. nov. appartient clairement à Meryta sect. Meryta ( Harms 1938) , incluant les espèces où les fleurs femelles et les fruits sont accolés à la base; elle ressemble le plus à M. lanceolata et M. raiateensis des Îles de la Société, avec lesquelles elle partage une même structure d’inflorescence et des ovaires libres accolés basalement les uns aux autres, mais s’en distingue par la forme des feuilles (obovale à spatulée pour M. puruhi sp. nov., lancéolée à oblongue pour M. lanceolata et M. raiateensis ) et le nombre de carpelles, (7-)8 à 11 pour M. puruhi sp. nov. et 4 à 6(-7) pour les deux autres ( Welsh 1998). Notre nouvelle espèce peut être facilement distinguée des deux espèces tahitiennes dotées de feuilles presque sessiles, M. drakeana Nadeaud et M. mauruensis Nadeaud , ainsi que de M. lucida J.W.Moore et M. salicifolia J.W.Moore , connues aussi de la Société et à feuilles petites et très étroites. Les fruits de Meryta puruhi sp. nov. ne sont pas soudés en un syncarpe comme ceux de M. brachypoda Harms et de M. pauciflora Hemsl. ex Cheeseman des archipels des Australes, Cook et Pitcairn. Comparée aux membres de Meryta sect. Choristomeryta Harms , incluant les espèces où les fleurs femelles et les fruits sont entièrement libres les uns des autres, M. puruhi sp. nov. se distingue de M. pastoralis F.Tronchet & Lowry des Îles Marquises par ses fruits basalement accolés et par ses feuilles à pétioles plus longs (> 3 cm) et à limbes largement obovales contre des pétioles plus courts (<3 cm) et des limbes étroitement obovales. Meryta puruhi sp. nov. peut également être distingué de M. choristantha Harms de l’île de Rapa aux Australes, un autre membre de M. sect. Choristomeryta, par son plus grand nombre de carpelles (de 7 à 11 contre 5 ou 6). Enfin, M. puruhi sp. nov. possède des pétioles et des feuilles beaucoup plus courts que ceux de l’espèce tahitienne non décrite se rapprochant de M. macrophylla (W.Rich ex A.Gray) Seem. des Samoa (pétioles de 10-12 contre 3-6 cm, et feuilles de 33-43 contre 16-24 cm de longueur).
La présence de Meryta puruhi sp. nov. sur les atolls surélevés de Niau et Anaa et son absence des atolls bas de l’archipel des Tuamotu reflète la plus grande diversité d’habitats sur les premiers. Niau et Anaa ont servi de refuges pour la flore et la faune durant les transgressions marines du dernier millénaire ( Montaggioni et al. 2018), comme démontré pour l’avifaune ( Cibois et al. 2011). L’absence de Meryta puruhi sp. nov. de l’atoll surélevé de Makatea (110 m) est surprenante, mais peut illustrer la nature stochastique de la colonisation des plantes entre les îles, ou peut aussi être le résultat d’une extinction locale liée à l’exploitation du phosphate qui s’est déroulée à Makatea entre 1917 et 1966.
Afin de promouvoir la conservation de Meryta puruhi sp. nov., nous recommandons le classement réglementaire au sein de la liste des espèces protégées de Polynésie française de cette espèce menacée. De plus, son habitat sur les atolls de Niau et Anaa, la forêt naturelle à Planchonella-Xylosma sur corail surélevé, devrait faire l’objet d’une protection au sein des plans généraux d’aménagement des communes de Anaa et de Fakarava, cette dernière englobant Niau et étant une réserve de biosphère de l’UNESCO (commune de Fakarava). Une autre mesure potentiellement pertinente pourrait être la réintroduction du ptilope des Tuamotu, Ptilinopus coralensis , sur l’atoll de Anaa, où il est éteint localement depuis plus d’une centaine d’années et où la sous-population de M. puruhi sp. nov. décline lentement en raison d’une dissémination et d’une régénération réduite. Enfin, différentes espèces du genre Meryta se multipliant relativement aisément par graines ou par boutures de rameaux juvéniles et réitérations de tige ( Gâteblé 2015), il pourrait être envisagé de la cultiver afin de constituer des plantations conservatoires ex situ et de réaliser des renforcements de populations in situ.
No known copyright restrictions apply. See Agosti, D., Egloff, W., 2009. Taxonomic information exchange and copyright: the Plazi approach. BMC Research Notes 2009, 2:53 for further explanation.
|
Kingdom |
|
|
Phylum |
|
|
Class |
|
|
Order |
|
|
Family |
|
|
Genus |